拟南芥PDLP7调节胞间连丝功能与胼胝质降解所需的BG10依赖性葡萄糖苷酶活性有关
该项研究由武汉大学高等研究院、北京大学生命科学学院蛋白质与植物基因国家重点实验室朱玉贤教授领导
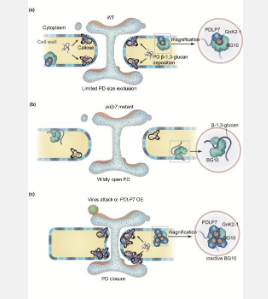
胞间连丝(PD) 是细胞壁中促进相邻细胞间通讯的特殊通道。PD 微区由不同的蛋白质、鞘脂和固醇组成。胞间连丝定位蛋白 (PDLP) 是一种关键成分,因其在抵御致病细菌感染方面发挥的关键作用而闻名。然而,PDLP 对胞间连丝结构和功能的确切影响仍不确定。
在拟南芥中,PDLP 家族由 8 个成员组成。本研究发现,PDLP5 和 PDLP7 能够通过位于其羧基末端 (C 端) 跨膜区的鞘脂结合基序与鞘氨醇 t18:0 结合。进一步的病毒接种实验表明,PDLP1、PDLP5和PDLP7在芜菁花叶病毒(TuMV) 感染后显著上调,而PDLP2、PDLP3和PDLP7在黄瓜花叶病毒(CMV) 感染后显著上调。PDLP7 的显著上调表明其能够同时应对两种病毒的感染。与野生型 (WT) 植物相比,pdlp7突变体表现出 TuMV 的加速扩散和 CMV 的增加积累,这表明 PD 通透性增加。通过高压冷冻样品制备结合聚焦离子束扫描电子显微镜 (FIB-SEM) 观察发现,与 WT 相比,pdlp7 突变体中的 PD 直径增大。pdlp7突变体植物的胼胝质沉积显著减少。这些植物的 β-1,3-葡聚糖酶活性增加,但胼胝质合酶活性没有变化。共免疫沉淀-质谱法表明,PDLP7 相关蛋白的基因本体注释中排名最高的蛋白质与“水解酶活性”相关。此外,在酵母双杂交实验中发现 PDLP7 与葡聚糖内切-1,3-β-葡萄糖苷酶 10 (BG10) 特异性相互作用。在 bg10突变体植物中持续观察到更高水平的胼胝质沉积和更慢的病毒传播。此外,PDLP7与BG10的相互作用依赖于PDLP7 N末端的Gnk2同源1(GnK2-1)结构域而非GnK2-2结构域。结构模拟和分子对接分析表明,GnK2-1结构域中的35-天冬氨酸(D 35 )、42-赖氨酸(C 42)、44-谷氨酰胺(Q 44)和116-亮氨酸(L 116)是该相互作用所必需的。
生化和结构模拟分析表明,PDLP7 具有直接与胼胝质结合的能力。分子对接结果表明,与 GnK2-2 同源域相比,GnK2-1 域与胼胝质的结合更稳定。远紫外圆二色性实验表明,构象变化可能取决于胼胝质和 GnK2-1 之间的关系。GnK2-1 ( ProPDLP7:GnK2-1 × 2 ),而非 GnK2-2 ( ProPDLP7:GnK2-2 × 2 ) 补充了pdlp7植物中的胼胝质含量和病毒传播表型。
这些数据表明,PDLP7 和 BG10 的 GnK2 结构域共同促进胼胝质的积累和降解,控制胞间连丝的打开和关闭,从而限制病毒的传播。这项研究的结果阐明了胞间连丝微区内蛋白质和植物多糖之间的相互作用,为增强植物抗病毒防御能力和农业生产力提供了新的见解。
免责声明:本答案或内容为用户上传,不代表本网观点。其原创性以及文中陈述文字和内容未经本站证实,对本文以及其中全部或者部分内容、文字的真实性、完整性、及时性本站不作任何保证或承诺,请读者仅作参考,并请自行核实相关内容。 如遇侵权请及时联系本站删除。
